Home » Posts tagged 'gaya London'
Tag Archives: gaya London
IKATAN KIMIA
IKATAN KIMIA
Ikatan Kimia
Ikatan kimia adalah sebuah proses fisika yang bertanggung jawab dalam interaksi gaya tarik menarik antara dua atom atau molekul yang menyebabkan suatu senyawa diatomik atau poliatomik menjadi stabil. Dengan kata lain ikatan kimia adalah kemampuan suatu atom bergabung dengan atom lain membentuk suatu senyawa.
Ikatan kimia dilakukan dengan melepas atau menerima electron, sehingga susunan electron menjadi stabil (seperti susunan pada gas mulia)
Kecenderungan unsur – unsur untuk menjadikan konfigurasi elektronnya sama seperti gas mulia terdekat dengan istilah aturan oktet
Elektron yang berperan dalam pembentukkan ikatan kimia adalah electron valensi dari suatu atom / unsur yg terlibat.
Ikatan kimia dapat dibedakan menjadi tiga macam yaitu ikatan ionik , ikatan kovalen dan ikatan kovalen koordinasi
1. Ikatan ion
Ikatan ion merupakan sejenis interaksi elektrostatik antara dua atom yang memiliki perbedaan elektronegatifitas yang besar
Ikatan ion terjadi apabila :
– Ikatan antara unsur logam dan bukan unsur logam
– Terjadi jika atom unsur yang memiliki energi ionisasi kecil / rendah melepaskan elektron valensinya (membentuk kation) dan atom unsur lain yang mempunyai afinitas elektron besar menangkap elektron tersebut (membentuk anion)
– Unsur logam melepaskan elektron sedangkan unsur non logam menerima elektron
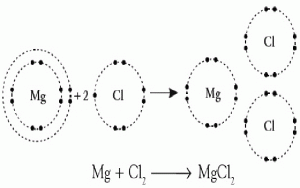
Contoh : Ikatan ion yang membentuk senyawa KCl
KCl
19K : 2.8.8.1 17Cl : 2.8.7
Perhatikan jumlah elektron terluar pada susunan elektron dari kedua unsur diatas.
K akan melepaskan 1 elektron valensi
K ————-> K+
Cl menangkap 1 elektron valensi.
Cl ————> Cl–
Dengan begitu didapat susunan elektron dari kedua elektron yang stabil ( elektron kulit terluarnya berjumlah 8).
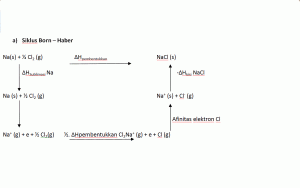
Pembentukan senyawa ionik sebagian berupa Siklus Born – Haber
a) Siklus Born – Haber
Pada pembentukkan senyawa ionik NaCl (s) dari Na ( s) dan Cl2 (s) diatas melibatkan serangkaian proses yang dinamakan dengan siklus Born-Haber
Entalpi kisi ( ∆Hkisi) merupakan perubahan entalppi standar yang menyertai pembentukan ion – ion gas dari padatan Kristal :
MX (s) ———> M+ (g) + X– (g) = ∆Hkisi
Semua entalpi kisi bernilai positif . Entalpi kisi berasal dari konstribusi energy elektrostatik total kation dan anion yang ada pada padatan ionik.
Contoh Soal :
Tentukan silus Born-Haber dan kalor pembentukkan LiF bila diketahui :
Kalor penguapan Li (s) = + 155 kJ/mol
Kalor disosiasi F2 (g) = + 158 kJ/mol
Energi kisi LiF (s) = – 1.016 kJ/mol
Energi ionisasi K (g) = +520 kJ/mol
Afinitas elektron (g) = – 328 kJ/mol
Solusi
Li(e) + ½F2 (g) ——> ∆H ——-> LiF (g)
F (g) ——> A ——-> F–
Li ( g) ——-> I ———–> Li+(g)
∆Hfo = S + I +½D + A + U
= ( 155 + 520 + 79 – 328 – 1016 ) kJ
= – 590 kJ/mol
2. Ikatan Kovalen
Ikatan kovalen adalah ikatan yang terjadi jika ada pemakaian pasangan elektron secara bersama- sama oleh atom-atom yang berikatan, dikarenakan ketidak mampuan salah satu atom yang akan berikatan untuk melepaskan elektron ( terjadi pada atom – atom non logam).
Sifat – sifat atom yang membentuk ikatan kovalen sebagai berikut :
· Terbentuk diantara dua atom yang sama-sama ingin menangkap elektron
· Sesudah berikatan tiap atom harus dikelilingi 2 atau 8 elektron
· Atom-atom yang memiliki afinitas elektron tinggi serta beda keelektronegatifannya lebih kecil dibandingkan ikatan ion.
Ikatan kovalen terbagi atas dua macam berdasarkan kepolarannya antara lain :
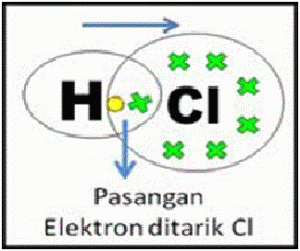
a) Ikatan Kovalen Polar
Ikatan kovalen polar terjadi jika pasangan elektronnya yang dipakai bersama-sama, tertarik lebih kuat ke salah satu atom yang berikatan (berdasarkan atas keelektronegatifan unsurnya berbeda).
Elektron akan tertarik lebih kuat ke atom yang elektronegatif lebih besar (cenderung menangkap elektron)
Contoh :
b) Ikatan Kovalen Non Polar
Ikatan kovalen non polar terjadi jika pasangan elektron yang dipakai bersama, sama kuat ke semua atom yang berikatan. Ikatan ini terjadi dengan syarat dua atom yang berikatan mempunyai keelektronegativitas yang sama.
Pada molekul yang simetris seperti CaCl2, BaCl2 , AlCl3 dan CCl4 polaritas masing – masing ikatan akan saling meniadakan sehingga molekul tersebut bersifat non polar.
Contoh :
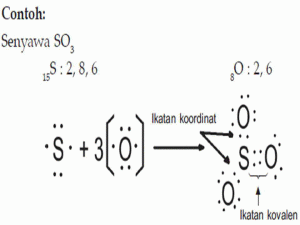
3. Ikatan Kovalen Koordinasi
Ikatan kovalen koordinasi adalah ikatan kovalen dengan pasangan elektron yang digunakan secara bersama hanya berasal / disumbangkan oleh salah satu atom
Berikut Tabel perbedaan antara ikatan ionik , kovalen dan kovalen koordinasi
|
Perbedaan |
Ionik |
Kovalen |
Kovalen Koordinasi |
| Proses Pembentukkan | Serah terima elektron antar atom | Penggunaan bersama pasangan elektron dimana tiap atom menyumbang elektron
X. + .Y à X:Y |
Penggunaan bersama pasangan elektron yang hanya berasal dari salah satu atom
X: + Y à X:Y |
| Atom yang terlibat | Logam + Nonlogam | Nonlogam + Nonlogam | Nonlogam + Nonlogam |
| Titik leleh & Titik Didih | Tinggi | Rendah ( kecuali pada padatan kovalen seperti intan ) | Rendah |
| Kealrutan | Larut dalam air namun sukar larut dalam pelarut organik seperti aseton, alcohol,eter dan Benzena | Sukar larut dalam air namun larut dalam pelarut organik | Sukar larut dalam air namun larut dalam pelarut organic |
| Daya Hantar Listrik | Lelehan dan larutannya menghantarkan listrik | Tidak dapat menghantarkan listrik (namun ada beberapa larutannya yg menghantarkan listrik) | Tidak dapat menghantarkan listrik (namun ada beberapa larutannya yg menghantarkan listrik) |
| Contoh | NaCl , LiF, CaO, CaBr2 , AlCl3 | HF, H2O, PCl3 , BCl3 , CO2 | NH4+ , SO4-2 , POCl3, H3NBF3 , SO3 |
Kesimpulannya Kepolaran suatu senyawa dipengaruhi oleh adanya perbedaan keelektronegatifan antara atom – atom yang berikatan dan bentuk molekul. Suatu senyawa akan dikatakan polar apabila selisih keelektronegatifan antara atom penyusunnya semakin besar. Selain itu ketidaksimetrisan bentuk molekul juga menyebabkan senyawa bersifat polar. Adanya muatan elektron yang tidak seimbang antar atom dalam senyawa polar mengakibatkan terjadinya suatu kutub (dipol). Oleh karena itu, pasangan elektron yang digunakan untuk membentuk ikatan kovalen polar lebih kuat tertarik pada salah satu atom.
Sebaliknya suatu senyawa dikatakan bersifat nonpolar jika terbentuk dari atom sejenis atau senyawa yang distribusi muatannya simetris contoh H2 atau CH4. Harga elektronegatifitas atom – atom dalam molekul nonpolar sama, sehingga muatan elektronnya terdistribusi secara merata. Oleh karena itu molekul nonpolar tidak membentuk kutub. Pasangan elektron senyawa nonpolar mengakibatkan bentuk molekul simetris sehingga dipol – dipol ikatannya saling meniadakan.
4. Ikatan Hidrogen
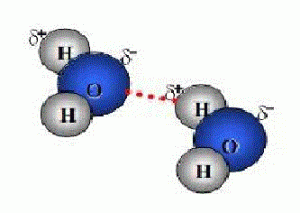
Ikatan Hidrogen adalah ikatan yang terbentuk karena adanya gaya tarik menarik atom yang elektronegatifitasnya sangat besar, ikatan ini merupakan ikatan antar molekul yang sangat polar, ikatan ini lebih kuat daripada ikatan van der walls dan mempunyai arah yang jelas seperti atom F,O, dan N terhadap atom H. Contohnya : NH3 , H2O dan HF
Dengan adanya ikatan hidrogen menyebabkan terjadinya keadaan sebagai berikut :
· Air mempunyai Mr kecil akan tetapi mempunyai titik didih yang tinggi ( setiap senyawa yang mempunyai ikatan hidrogen mempunyai titik didih yang tinggi ).
· Molekul air lebih berdekatan ( jarak antara molekul ) dibandingkan molekul es (padat), yang akan mengakibatkan es mengapung di atas air.
Ikatan Hidrogen merupakan ikatan antar molekul yang sangat polar dan mengandung atom hidrogen. Dalam keadaan cair atom hidrogen dalam molekul air yang parsial positif (δ+) ditarik oleh pasangan elektron atom O molekul lain yang elektronegatif, sehingga terbentuk ikatan hidrogen.
Ikatan Hidrogen jauh lebih kuat daripada gaya-gaya van der walls. Zat yang mempunyai ikatan hidrogen memerlukan energy yang besar untuk memutuskannya. Oleh karena itu titik didih dan titik lelehnya sangat tinggi.
5. Ikatan Van der Walls
Ikatan van der walls adalah gaya tarik menarik antarmolekul (antar kutub) dalam senyawa yang berikatan kovalen. Gaya ini merupakan gaya antarmolekul yang sangat lemah Mencakup interaksi dipole – dipole (pada senyawa polar) dan interaksi dipole terimbas/terinduksi (pada senyawa polar dan non polar). Sedangkan interaksi dipole sementara (pada senyawa non polar) biasa disebut dengan gaya dispersi London.
Semakin besar Mr suatu senyawa (semakin banyak jumlah partikel yang saling tarik) ikatan van der walls akan semakin kuat, sehingga energy yang dibutuhkan untuk memutuskan ikatan antarmolekul semakin besar. Akibatnya titik leleh dan titik didih senyawa tersebut akan semakin besar.
Pada ikatan Van der walls dibagi menjadi 2 bagian yaitu gaya London dan gaya tarik dipol
- Gaya London
Gaya London ditemukan oleh Fisikawan Jerman yang bernama Fritz London. Gaya London (gaya dispersi) merupakan gaya tarik menarik antar molekul nonpolar akibat adanya dipol terimbas yang ditimbulkan oleh perpindahan elektron dari satu orbital ke orbital lain membentuk dipol sesaat. Gaya London mengakibatkan molekul nonpolar bersifat agak polar.
Kemudahan suatu molekul menghasilkan dipol sesaat yang dapat mengimbas ke molekul sekitarnya disebut polarisabilitas. Polariabilitas berkaitan dengan massa molekul relatif (Mr) dan bentuk molekul. Jika massa molekul relatif semakin besar maka molekul semakin mudah mengalami polarisasi sehingga gaya London semakin kuat. Dengan massa molekul relatif yang sama besar molekul yang bentuknya panjang lebih mudah mengalami polarisasi dibandingkan dengan molekul yang kecil, kompak dan simetris. Semakin mudah mudah molekul mengalami polarisasi semakin tinggi titik didih dan titik lelehnya. Oleh karena itu jika masa molekul relatif zat semakin besar maka titik didih dan titik lelehnya semakin tinggi.
Namun gaya London relatif lemah sehingga apabila suatu zat yang molekulnya hanya mengalami tarik menarik berdasarkan gaya London saja maka titik didih dan titik lelehnya lebih rendah dibandingkan zat lain yang mengalami tarik-menarik tidak hanya berdasarkan gaya London saja (Mr hampir sama).
- Gaya Tarik Dipol
Gaya Tarik Dipol adalah suatu molekul – molekul polar yang cenderung menyusun diri dengan cara saling mendekati kutub positif dari suatu molekul dengan kutub negatif molekul yang lain.
Semakin besar momen dipol yang dimiliki oleh suatu senyawa, semakin besar gaya tarik menarik dipol yang dihasilkan. Gaya ini lebih kuat dibandingkan dengan gaya London. Oleh karena itu, molekul yang mengalami gaya tarik dipol memiliki titik didih dan titik leleh yang lebih tinggi daripada molekul yang mengalami gaya London (Mr hampir sama).
Gaya Tarik dipol terdiri atas 5 jenis yang berbeda antara lain :
- Gaya Dipol – Dipol
Gaya ini akan terjadi jika sesama senyawa kovalen polar saling berinteraksi. Senyawa kovalen polar memiliki 2 dipol yaitu dipol positif (δ+) dan dipol negatif (δ–). Interaksi antara dipol (-) dari satu molekul dengan dipol (+) dari satu molekul yang lain akan menimbulkan gaya tarik yang relatif lemah.
Kekuatan gaya tarik dipol – dipol ini akan semakin besar jika molekul – molekul mengalami penataan dengan ujung (+) suatu molekul mengarah keujung (-) dari molekul yang lain.
- Gaya Dipol Sesaat.
Jenis gaya ini umumnya dimiliki oleh senyawa kovalen nonpolar. Berbeda dengan senyawa kovalen polar, senyawa kovalen nonpolar tidak memiliki dipole. Gaya ini terjadi akibat adanya pergerakan elektron mengelilingi inti atom secara acak, sehingga pada suatu saat elektron – elektron tersebut akan mengumpul pada salah satu sisi atom dari molekul. Dipol yang terjadi ini akan segera menghilang atau berpindah tempat (sisi) seiring dengan berputarnya elektron.
- Gaya Dipol – Dipol Terinduksi (gaya imbas)
Jika suatu molekul polar berdekatan dengan molekul nonpolar maka molekul polar dapat menginduksi molekul nonpolar, akibatnya molekul nonpolar tersebut akan memiliki dipol terinduksi / dipol sesaat karena elektron – elektronnya akan mengumpul pada salah satu sisi molekul ( terdorong atau tertaik ).
Gaya dipol – dipol terinduksi (gaya imbas) adalah suatu dipol dari molekul polar akan saling tarik menarik dengan dipol terinduksi dari molekul nonpolar.
- Gaya Ion – Dipol
Gaya jenis ini terjadi antara senyawa ion dan senyawa kovalen polar. Ketika dilarutkan dalam senyawa kovalen polar, senyawa ion ini akan terionisasi menjadi kation dan anion. Kation akan tarik-menarik dengan dipol negatif sedangkan anion akan tarik-menarik dengan dipol positif.
- Gaya Ion – Dipol Sesaat
Mekanisme terjadinya gaya ini dikarenakan kombinasi dari proses terjadinya gaya dipol – dipol terinduksi dengan gaya ion – dipole. Jika ion dari senyawa ion berdekatan dengan molekul nonpolar maka ion tersebut dapat menginduksi dipol molekul nonpolar. Dipol terinduksi molekul nonpolar yang dihasilkan akan berikatan dengan ion.
Jenis gaya seperti ini memegang peranan penting dalam sirkulasi darah di dalam tubuh. Ion Fe2+ dalam haemaglobin akan mengalami gaya ion – dipol sesaat dengan molekul O2. Kation Fe2+ akan menginduksi molekul O2 yang bersifat nonpolar, kemudian dipol terinduksi yang dihasilkan akan berikatan dengan kation Fe2+.
6. Ikatan Logam
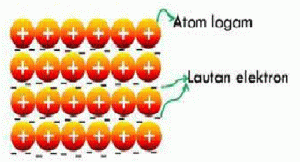
Ikatan Logam adalah ikatan yang terbentuk karena elektron-elektron pada logam dapat bergerak bebas membentuk awan elektron yang mengikat logam-logam bermuatan positif. Awan elektron yang dapat bergerak bebas ini dapat menghantarkan arus listrik.
Atom logam mempunyai sedikit valensi sehingga sangat mudah untuk dilepaskan dan membentuk ion positif, dikarenakan kulit terluar atom logam relatif longgar (terdapat banyak ruang kosong) sehingga memungkinkan elektron dapat berpindah dari satu atom ke atom yang lain.
Mobilitas (pergerakan) elektron dalam logam sedemikian bebas sehingga elektron valensi logam mengalami delokalisasi yaitu suatu keadaan dimana elektron valensi tersebut tidak tetap pada posisinya akan tetapi senantiasa berpindah – pindah dari satu atom ke atom lainnya.
Gambar Ikatan Logam yang terbentuk.
7. Ikatan Valensi
Ikatan valensi yaitu ikatan yang terbentuk melalui tumpang tindih (overlap) orbital valensi antara atom satu dengan atom lainnya. Orbital yang mengalami overlap harus memiliki hanya satu elektron dengan spin yang berlawanan. Overlapping terjadi apabila orientasi ( bentuk) orbital sesuai.
Overlapping orbital p dapat terjadi dalam dua orientasi yang berbeda yaitu overlapiing muka-muka dan badan-badan. Overlapping antar muka menghasilkan ikatan σ dan overlapping antar badan menghasilkan ikatan ∏.